好的,遵照您的要求,我将不遗漏地对您提供的学习材料中的每一个例子进行详细、具体的复述和解释,并为每个例子配上具体的数值示例和说明。
引言:极性共价键 (Polar Covalent Bond)
核心概念复述与解释: 当两个原子通过共用电子对形成共价键时,如果这两个原子的电负性 (electronegativity) 不同,那么电子对会更偏向电负性较强的原子。这种电子云分布不均匀、不对称的现象就导致了极性共价键的形成。电负性强的原子一端带有部分负电荷(用 表示),电负性弱的原子一端带有部分正电荷(用 表示)。
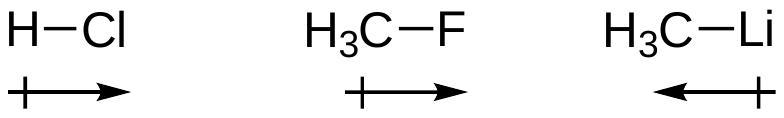
图示解释: 这张图展示了从非极性共价键(如 或 ,电子完全均匀共享)到极性共价键(如 ,电子偏向 )再到离子键(如 ,电子几乎完全从 转移到 )的渐变过程。这个过程的根本驱动力就是成键原子间电负性的差异。
1. 感应效应 (Inductive Effect) 与 偶极矩 (Dipole Moment)
核心概念复述与解释: 感应效应特指由于电负性差异,沿着 键(单键)传递的电子云密度位移效应。这种电荷分离可以用一个物理量——偶极矩 () 来衡量。偶极矩是一个矢量,其方向从正电荷中心指向负电荷中心。其大小由公式 决定,其中:
- 是分离的电荷量。
- 是正负电荷中心之间的距离。 偶极矩的单位通常是德拜 (Debye, D)。
一个分子的总偶极矩近似等于其内所有键偶极 (bond dipoles) 的矢量和。这意味着,即使分子内含有极性键,如果分子的几何构型是对称的,键偶极可能会相互抵消,导致整个分子的偶极矩为零。
详细例子分析:
-
例1: (氯化钠)
-
复述: 氯化钠的偶极矩为 9.0 D。
-
详细解释: 钠 (Na) 的电负性约为 0.93,氯 (Cl) 的电负性约为 3.16,两者差异极大 ()。这导致电子几乎完全从钠转移到氯,形成 离子和 离子,它们之间通过静电引力结合,这实际上是离子键,可以看作是极性共价键的极端情况。因此,它具有非常大的偶极矩。
-
数值示例: 假设电子完全转移,则电荷量 为一个基本电荷,即 库仑 (C)。气相中 的键长 约为 米 (m)。
将单位换算为德拜 (1 D = C·m):
理论计算值 (11.3 D) 与实验值 (9.0 D) 存在差异,这表明即使在氯化钠中,电子转移也不是100%完全的,该键仍具有一定的共价性。
-
-
例2: (氯甲烷)
- 复述: 氯甲烷的偶极矩为 1.87 D。
- 详细解释: 氯 (Cl, 电负性~3.16) 的电负性远大于碳 (C, ~2.55),因此 键是强极性键。电子云偏向氯原子,使得氯带部分负电荷 (),碳带部分正电荷 ()。虽然 键的极性很小(氢的电负性~2.20),但分子的四面体结构并不完全对称,所以键偶极无法完全抵消,最终表现出显著的偶极矩。
- 数值示例: 键的键偶极是主要的贡献者。其他三个 键的键偶极的矢量和方向与 键偶极方向相反,但数值小得多,因此总偶极矩方向指向氯原子,大小为 1.87 D。
-
例3: (水)
-
复述: 水的偶极矩为 1.85 D。
-
详细解释: 氧 (O, ~3.44) 的电负性远大于氢 (H, ~2.20)。因此,两个 键都是强极性键,电子云偏向氧原子。水分子的构型是 V 形(角形),键角约为 104.5°。两个 键偶极的矢量和不会抵消,而是叠加成一个指向氧原子的净偶极矩。
-
数值示例与图示: 假设每个 键的键偶极为 。总偶极矩 的大小为:
将 D 代入,可以反算出单个 键的键偶极约为 1.5 D。
-
-
例4: (氨)
- 复述: 氨的偶极矩为 1.47 D。
- 详细解释: 氮 (N, ~3.04) 的电负性大于氢 (H, ~2.20),所以三个 键都是极性键。氨分子是三角锥形,三个 键偶极的矢量和方向向上,同时氮原子上还有一对孤对电子,其自身也贡献一个偶极矩,方向同样向上。两者叠加,产生一个显著的净偶极矩。
- 数值示例: 三个 键偶极的矢量和与孤对电子的偶极矩同向增强,总和为 1.47 D。
-
例5: (甲烷)
- 复述: 甲烷的偶极矩为 0。
- 详细解释: 虽然碳 (C, ~2.55) 和氢 (H, ~2.20) 之间存在微弱的电负性差异,使得 键具有微弱的极性。但是,甲烷分子是正四面体结构,这是一个高度对称的结构。四个 键偶极在空间中均匀分布,它们的矢量和正好相互抵消。
- 数值示例与图示: 想象四个大小相等、方向从中心指向四面体顶点的矢量,它们的合矢量为零。因此,尽管有极性键,整个分子是非极性的。
-
例6: (二氧化碳)
- 复述: 二氧化碳的偶极矩为 0。
- 详细解释: 氧 (O, ~3.44) 的电负性远大于碳 (C, ~2.55),所以两个 双键都是强极性键。但是,二氧化碳是线性分子,结构对称。两个 键偶极大小相等,方向完全相反(一个指向左边的氧,一个指向右边的氧)。
- 数值示例与图示: 两个大小相等、方向相反的矢量,其矢量和为零。。因此,分子整体是非极性的。
2. 形式电荷 (Formal Charge, FC)
核心概念复述与解释: 形式电荷是一种理论上的“电子记账”工具,用于确定一个分子或离子中每个原子的电荷分布。它假设所有共价键中的电子都被成键原子平均分配。这有助于我们画出更合理的路易斯结构 (Lewis structure) 并理解反应机理。 计算公式为:
或者简化为:
详细例子分析:
-
例1: (氨)
- 复述: 在氨分子中,氮和氢的形式电荷都是 0。
- 详细解释:
- 对于氮原子 (N):
- 氮是第 VA 族元素,自由原子的价电子数 = 5。
- 在 中,氮形成了 3 个 单键,所以共享电子数 = 。
- 氮原子上有 1 对孤对电子,所以非键合电子数 = 2。
- 计算: 。
- 对于氢原子 (H):
- 氢是第 IA 族元素,自由原子的价电子数 = 1。
- 在 中,每个氢形成了 1 个 单键,所以共享电子数 = 。
- 氢原子上没有孤对电子,所以非键合电子数 = 0。
- 计算: 。
- 对于氮原子 (N):
- 数值示例: 整个分子的总形式电荷 = ,与氨分子是中性分子相符。
-
例2: 一个有机阴离子的共振结构
- 复述: 在该结构中,甲基碳的形式电荷为0,氧为+1,端基碳为-1。
- 详细解释:
- 对于甲基碳 C() 和与之相连的中心碳: (原文中 的表述可能指代中心碳)
- 中心碳: 价电子数 = 4。形成了 4 个单键(与O, C, C相连),成键数 = 4。无孤对电子。
- 计算: 。(原文计算 也是对的,8是共享电子数)。
- 对于氧原子 (O):
- 价电子数 = 6。形成了 3 个键(一个双键,一个单键),共享电子数 = 6。有 1 对孤对电子,非键合电子数 = 2。
- 计算: 。
- 对于带负电荷的端基碳 (C:):
- 价电子数 = 4。形成了 3 个键(一个单键,两个与H相连),共享电子数 = 6。有 1 对孤对电子,非键合电子数 = 2。
- 计算: 。
- 对于甲基碳 C() 和与之相连的中心碳: (原文中 的表述可能指代中心碳)
- 数值示例: 分子总电荷 = 。(这里假设它是一个更大分子的一部分,且整体中性)。这个例子展示了形式电荷如何帮助我们识别分子内电荷分离的情况。
-
例3: 硝基甲烷 ()
- 复述: 在硝基甲烷的一个共振结构中,N 的形式电荷为 +1,与 N 形成双键的 为 0,形成单键的 为 -1。
- 详细解释:
- 对于氮原子 (N):
- 价电子数 = 5。形成了 4 个键(一个 单键,一个 双键,一个 单键),共享电子数 = 。无孤对电子。
- 计算: 。
- 对于双键氧原子 ():
- 价电子数 = 6。形成了 1 个双键,共享电子数 = 4。有 2 对孤对电子,非键合电子数 = 4。
- 计算: 。
- 对于单键氧原子 ():
- 价电子数 = 6。形成了 1 个单键,共享电子数 = 2。有 3 对孤对电子,非键合电子数 = 6。
- 计算: 。
- 对于氮原子 (N):
- 数值示例: 分子总电荷 = ,与硝基甲烷是中性分子相符。这个例子为接下来的共振概念奠定了基础。
3. 共振 (Resonance)
核心概念复述与解释: 对于某些分子(特别是含有离域 键的分子),单一的路易斯结构无法准确描述其真实的电子分布。共振理论提出,这些分子的真实结构是多个可能的路易斯结构(称为共振结构)的杂化体 (hybrid)。
- 共振结构之间用双向箭头 连接。
- 共振不是动态平衡,分子并不会在不同结构间来回切换。真实的分子是所有共振结构的加权平均,是一个静态的、唯一的结构。
- 所有共振结构中,原子核的位置必须保持不变,只有电子(通常是 电子和孤对电子)的位置可以改变。
详细例子分析:
- 例: 硝基甲烷 ()

- 复述: 硝基甲烷的真实结构是两个不对称共振结构 和 的等权重共振杂化体。
- 详细解释:
- 在结构 中,负电荷在下方的氧原子上,上方的氧原子形成双键。
- 在结构 中,负电荷在上方的氧原子上,下方的氧原子形成双键。
- 这两个结构是等价的,能量相同,因此它们对共振杂化体的贡献是等权重的。
- 数值示例与说明:
- 键长: 实验测得硝基甲烷中两个 键的键长是完全相等的,约为 1.22 Å。这个值介于典型的 单键键长(约 1.36 Å)和 双键键长(约 1.21 Å)之间。这证明了每个 键都具有 "1.5键" 的特征。
- 电荷分布: 真实的硝基甲烷分子中,那个 -1 的形式电荷并不是固定在某一个氧原子上,而是平均分配在两个氧原子上。因此,每个氧原子实际带有约 的电荷。
- 波函数: 其波函数 精确地描述了这种等权重叠加的状态。
4. 共轭 (Conjugation)
核心概念复述与解释: 共轭是指分子中由相邻的、平行的 p 轨道相互重叠而形成的离域 电子体系。最典型的例子是交替的单双键体系,但也包括含有 p 轨道的阳离子、自由基或阴离子。共轭体系中的 电子不再局限于两个原子之间,而是在整个共轭体系中离域运动,这使得体系能量降低,更加稳定。
详细例子分析:
- 例: 烯丙基 () 体系
-
复述: 烯丙基体系由三个 杂化的碳原子组成,它们可以形成阳离子、自由基或阴离子。
-
详细解释: 三个碳原子 都是 杂化,每个碳原子都有一个垂直于分子平面的 p 轨道。这三个 p 轨道相互平行,可以“肩并肩”地重叠,形成一个跨越三个碳原子的离域 轨道。
-
具体数值示例与说明:
-
烯丙基阳离子 ():
体系中有 2 个 电子。共振结构显示,正电荷不是固定在 或 上,而是被平均分配。真实的阳离子中, 和 各带有约 的电荷。两个 键的键长和键级也是完全相同的,介于单键和双键之间。
-
烯丙基自由基 ():
体系中有 3 个 电子。未成对的电子(自由基)在 和 之间离域。
-
烯丙基阴离子 ():
体系中有 4 个 电子。负电荷被平均分配在 和 上,每个碳原子带有约 的电荷。同样,两个 键是等同的。
-
-
5. 使用弯箭头生成共振结构
核心概念复述与解释: 弯箭头是化学中用于表示电子对移动的符号。箭头从电子对的起始位置(如孤对电子、 键)指向其终止位置(如形成新键的位置或某个原子)。绘制共振结构时,必须遵循以下规则:
- 只移动电子对,不移动原子。
- 箭头总是从电子密度较高的地方(给电子体)指向电子密度较低的地方。给电子能力排序:带负电荷的孤对 > 中性孤对 > 键。
- 确保不违反八隅体规则(第二周期元素价层电子不能超过8个)。
详细例子分析:
-
例1: 从带负电荷的原子上的孤对开始 (烯醇负离子)

- 复述与解释:
- 箭头1: 从带负电荷的碳原子上的孤对电子开始,指向相邻的 键,表示这对电子将在此处形成一个新的 键 ( 双键)。
- 箭头2: 由于中间的碳原子不能有5个键(10个电子),原来的 双键中的 电子对必须断裂。箭头从 双键中间开始,指向氧原子,表示这对电子将成为氧原子上的孤对电子。
- 数值说明: 初始结构中,负电荷在碳上(碳负离子)。最终结构中,负电荷在氧上(氧负离子)。
- 复述与解释:
-
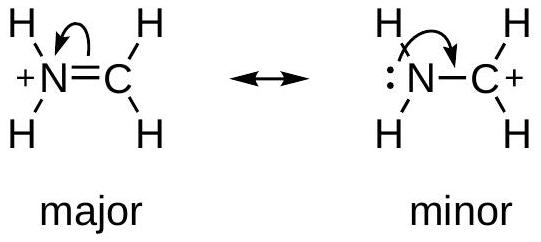
例2: 从中性原子上的孤对开始 (酰胺)

- 复述与解释:
- 箭头1: 从中性的氮原子上的孤对电子开始,指向 键,表示要形成 双键。
- 箭头2: 为了不违反碳的八隅体规则, 双键的 电子对移动到氧原子上,成为孤对电子。
- 数值说明: 初始结构是电中性的。最终结构中,氮原子失去电子对,形式电荷变为 ;氧原子得到电子对,形式电荷变为 。这是一个电荷分离的共振结构。
- 复述与解释:
-
例3: 从 键上开始 (苯酚)

- 复述与解释: 这个例子实际是从氧的孤对开始,驱动了 键的移动。
- 箭头1: 从氧的孤对电子开始,形成 双键。
- 箭头2: 相邻的苯环 双键的 电子对移动到下一个 键上。
- 箭头3: 原来的 双键的 电子对移动到碳原子上,形成一个带负电荷的孤对电子。
- 数值说明: 电子对从环外的氧原子移动到苯环内,导致苯环上的特定位置(邻位和对位)带有负电荷。
- 复述与解释: 这个例子实际是从氧的孤对开始,驱动了 键的移动。
6. 识别主要共振结构
核心概念复述与解释: 不同的共振结构对真实杂化体的贡献可能不等。贡献更大的结构称为主要共振结构,它更接近分子的真实状态。判断标准按重要性排序:
- 八隅体规则: 满足所有第二周期元素八隅体(价层有8个电子)的结构最稳定。
- 最小电荷分离: 形式电荷总数最少、电荷分离最小的结构更稳定。中性结构通常优于电荷分离的结构。
- 电负性: 如果必须有负电荷,它应该位于电负性最大的原子上;正电荷应位于电负性较小的原子上。
详细例子分析:
-
例1: 八隅体规则
- 复述: 对于这个阳离子,右边的结构是主要贡献者。
- 详细解释:
- 左边结构: 碳原子带正电荷,它只形成了3个键,周围只有6个价电子,不满足八隅体规则。氧原子满足八隅体。
- 右边结构: 氧原子带正电荷,但它和碳原子都满足了八隅体规则(碳形成四键,氧形成三键并有一对孤对)。
- 数值说明: 八隅体规则的满足是最高优先级。尽管右边结构将正电荷放在了电负性更高的氧原子上(违反规则3),但因为它满足了所有原子的八隅体,所以它仍然是主要共З振结构,比左边的缺电子结构稳定得多。
-
例2: 最小电荷分离
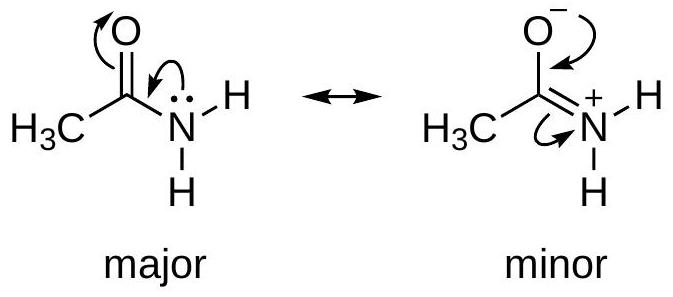
- 复述: 对于丙酮,左边的中性结构是主要贡献者。
- 详细解释:
- 左边结构: 所有原子的形式电荷均为0,没有电荷分离。
- 右边结构: 碳原子带 +1,氧原子带 -1。这是一个电荷分离的结构。
- 数值说明: 能量上,将正负电荷分离开需要消耗能量。因此,没有电荷分离的中性结构(左)总是比有电荷分离的结构(右)更稳定,贡献也更大。
-
例3: 负电荷位置
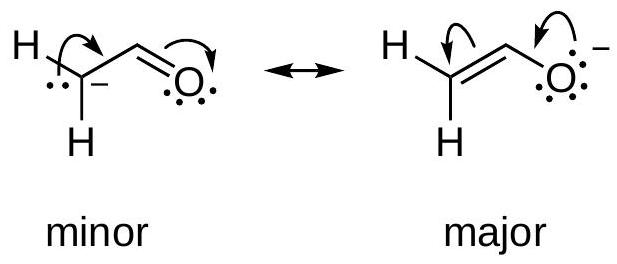
- 复述: 对于烯醇负离子,右边的结构是主要贡献者。
- 详细解释: 两个结构都满足八隅体规则,并且都带有一个单位的负电荷。此时需要比较负电荷所在原子的电负性。
- 左边结构: 负电荷在碳原子上。
- 右边结构: 负电荷在氧原子上。
- 数值说明: 氧的电负性 (3.44) 远大于碳 (2.55)。电负性越大的原子,稳定负电荷的能力越强。因此,将负电荷放在氧上的结构(右)比放在碳上的结构(左)更稳定,是主要共振结构。
7. 布朗斯特酸碱平衡 (Brønsted Acid-Base Equilibrium)
核心概念复述与解释: 根据布朗斯特-劳里 (Brønsted-Lowry) 理论:
- 酸 (Acid) 是质子 () 的给予体 (donor)。
- 碱 (Base) 是质子 () 的接受体 (acceptor)。 在一个酸碱反应中,酸失去质子后变成其共轭碱 (conjugate base),碱得到质子后变成其共轭酸 (conjugate acid)。
详细例子分析:
-
例1:
- 复述与解释:
- (盐酸) 给予一个质子 (),所以它是酸。
- (水) 接受这个质子,所以它是碱。
- 反应后, 失去了质子变成 (氯离子),所以 是 的共轭碱。
- 得到了质子变成 (水合氢离子),所以 是 的共轭酸。
- 复述与解释:
-
例2:
- 复述与解释:
- (甲铵离子) 给予一个质子,所以它是酸。
- (乙酸根离子) 接受这个质子,所以它是碱。
- 反应后, 失去了质子变成 (甲胺),所以 是其共轭碱。
- 得到了质子变成 (乙酸),所以 是其共轭酸。
- 复述与解释:
8. 酸强度通过 衡量
核心概念复述与解释: 酸的强度由其在溶液中的解离程度决定,用酸度系数 () 来量化。对于反应 :
- 值越大,酸性越强。 为了方便使用,通常用对数形式 表示:
- 值越小,酸性越强。 另外一个重要关系是:酸越强,其共轭碱越弱;酸越弱,其共轭碱越强。
详细例子分析:
-
例: 乙酸 ()
-
复述: 乙酸的 为 0.000025, 为 4.6。
-
详细解释:
- 乙酸在水中的解离反应为:。
- 其酸度系数 。这是一个小于1的数,说明乙酸是弱酸,在水中只有少量解离。
-
数值示例:
这个计算验证了给出的 值。
-
-
表格分析:
- (盐酸): ,是一个极小的负数,表明 是一个非常大的数 ()。因此盐酸是非常强的酸。其共轭碱 是非常弱的碱。
- (乙酸): ,是中等强度的弱酸。
- (水): ,是更弱的酸。其共轭碱 (氢氧根) 是强碱。
- (氨): ,是一个非常大的正数,表明 极小 ()。因此氨是极弱的酸。其共轭碱 (氨基负离子) 是极强的碱。
9. 判断酸碱平衡的方向
核心概念复述与解释: 化学平衡总是朝向能量更低、更稳定的一侧移动。在酸碱反应中,这意味着平衡会偏向生成更弱的酸和更弱的碱的一侧。判断方法是:
- 找出反应物和生成物中的两种酸。
- 比较它们的 值。
- 值较大的酸是弱酸。
- 平衡将有利于形成弱酸(高 值)的一侧。
详细例子分析:
-
例:
- 复述: 平衡倾向于左侧,即 和 的浓度更高。
- 详细解释:
- 找出酸: 反应物中的酸是 (甲铵离子),生成物中的酸是 (乙酸)。
- 比较 : 从表格或资料中查得:
- (根据讲义,实际值约10.6)
- 判断强弱: ,所以 是更弱的酸。
- 确定方向: 平衡有利于形成更弱的酸和更弱的碱。由于反应物这边包含了更弱的酸 (),所以平衡偏向左侧(反应物一侧)。
- 数值示例 (K_eq 推导与计算):
- 平衡常数
- 推导如原文所示,可得
- 计算:
- 说明: 是一个远小于 1 的数值,这意味着在平衡时,反应物的浓度远大于产物的浓度(具体来说是 倍)。这与“平衡偏向左侧”的结论完全一致。
10-13. 使用弯箭头描绘反应机理
这部分的核心是将之前学习的弯箭头规则应用到完整的化学反应中,以表示键的断裂和形成。
详细例子分析:
-
例10:
- 正向反应:

- 箭头1: 从 分子中氧原子的孤对电子出发,指向 分子中的氢原子。这表示:氧的孤对电子攻击了氢原子,形成一个新的 键。 作为碱(给电子体)。
- 箭头2: 从 共价键的中间出发,指向氯原子。这表示:原来的 键断裂,成键电子对完全转移给氯,成为氯离子的一对孤对电子。
- 逆向反应:

- 箭头1: 从 的孤对电子出发,指向 的一个氢原子。这表示: 作为碱,要夺取一个质子。
- 箭头2: 从被攻击的那个 共价键出发,指向氧原子。这表示: 键断裂,电子对还给氧原子,重新形成 的孤对电子。
- 正向反应:
-
例11-12: 一个共轭加成反应
- 复述与详细解释: 这是一个氢氧根离子 () 对一个 -不饱和羰基化合物的共轭加成反应。我们按照讲义的步骤来分析。
- 原子对应: 反应物中的原子在产物中都还在。
- 键的变化:
- 形成: 键、 键。
- 断裂: 键、 键。
- 绘制弯箭头 (核心步骤):

- 箭头 a: 从带负电荷的 的氧原子上的孤对电子开始,指向 。
- 原因: 是亲核试剂(富电子),而共轭体系的末端 是一个亲电位点(缺电子)。这一步形成了新的 键。
- 箭头 b: 形成新键后,将会有5个键,违反八隅体规则。因此,相邻的 键必须断裂。箭头从 键开始,指向 之间的位置。
- 原因: 这对电子移动过去,在 和 之间形成一个新的 键。这是一个典型的共轭体系电子传递。
- 箭头 c: 形成新 键后, 又会违反八隅体规则。因此, 的 键必须断裂。箭头从 键开始,指向氧原子。
- 原因: 这对电子成为氧原子上的孤对电子,并将负电荷转移到电负性最强的氧原子上,形成一个稳定的烯醇负离子中间体。
- 箭头 a: 从带负电荷的 的氧原子上的孤对电子开始,指向 。
- 数值说明: 这一系列弯箭头清晰地展示了电子对如何从最初的亲核试剂 () 流经整个共轭体系,最终停留在电负性最强的氧原子上,每一步都遵守了化学基本规则。
- 复述与详细解释: 这是一个氢氧根离子 () 对一个 -不饱和羰基化合物的共轭加成反应。我们按照讲义的步骤来分析。
希望这份详尽的复述、解释和数值示例对您有所帮助。